Progettazione & Engineering
Progettazione Meccanica
Rapid Prototyping
Reverse Engineering
Simulazioni FEM
Qualità e Validazione
Sistema Qualità
Validazione DQ IQ OQ PQ
Procedure Operative (SOP) (IOP)
Fascicolo Tecnico / Design Dossier
Design Control
DHF Design History File
Analisi e Gestione del Rischio
Valutazione Clinica
Testing
Test Meccanici
Analisi su Polimeri
Valutazione della Sicurezza Biologica
Mettiamo a disposizione la nostra esperienza per ottimizzare e/o costruire il vostro sistema di qualità in conformità con le normative Statunitensi e dell'Unione Europea.
Un Sistema Qualità designato per la gestione dei Dispositivi Medici è progettato per assicurare che i prodotti siano sicuri ed efficaci in relazione alla loro destinazione d'uso e costantemente soddisfino le specifiche come definito dai risultati di progettazione tecnica, clinica e / o dettagliato durante la convalida. Regolamentazioni e linee guida differenti devono essere considerati per il mercato EU o US :
- US: FDA 21 CFR 820 (Also known as the QSR), Guidance Documents
- EU: ISO 13485 , Essential Requirements, Harmonized Standards
Un Sistema Qualità FDA regolamento in base al CFR 21 part 820 è di per se armonizzato con lo standard ISO 13485: 2003, che a sua volta si basa sulla norma ISO 9001: 2000. La ISO 13485 delinea i requisiti per i produttori di dispositivi medici in aggiunta ai requisiti di sistema generali di qualità che si trovano nella ISO 9001. L' FDA ha armonizzato il suo QSR con le norme ISO, poichè molti altri paesi si affidano a norme ISO nella regolazione dispositivi medici.
Nel QSR, l'FDA ha identificato gli elementi essenziali che un sistema di qualità considerare:
– design,
– production,
– distribution
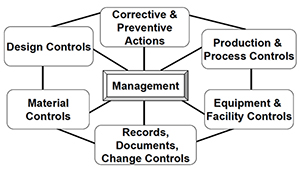
QS Regulation covers:
– Quality Management and Organization
– Device design
– Buildings
– Equipment
– Purchase and handling of components
– Production and process controls
– Packaging and labeling control
– Device evaluation
– Distribution
– Installation
– Complaint handling
– Servicing
– Records
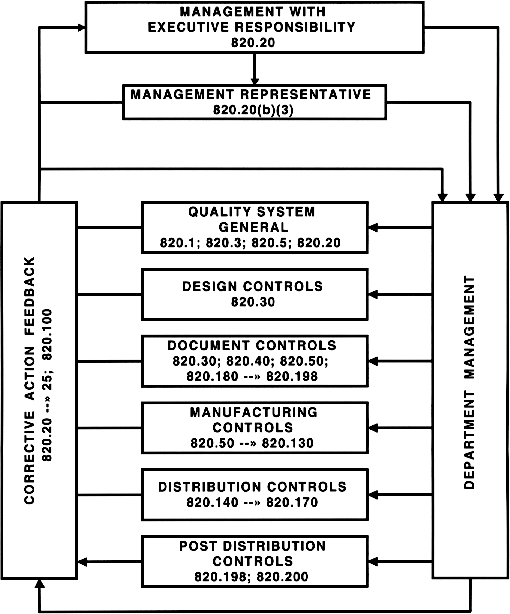
Other Important section from CFR 21: